براء
عضو وفي
- رقم العضوية :
- 24020
- البلد/ المدينة :
- *biskra*
- العَمَــــــــــلْ :
- 2 جامعي
- المُسَــاهَمَـاتْ :
- 5407
- نقاط التميز :
- 4841
- التَـــسْجِيلْ :
- 29/08/2011
الرابطة التساهمية : عبارة عن زوج من الالكترونات يربط بين ذرتين تكون نتيجة مساهمة كلِ من الذرتين بالكترون واحد من مستوى التكافؤ .
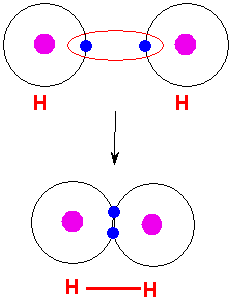
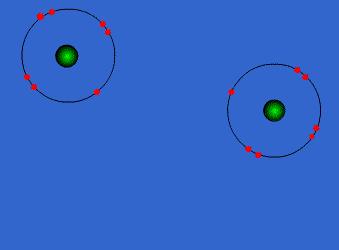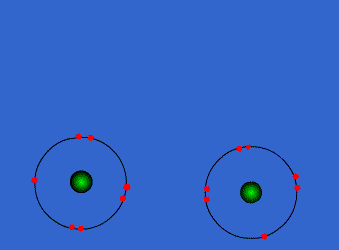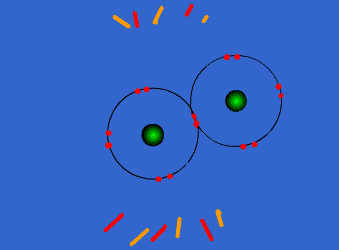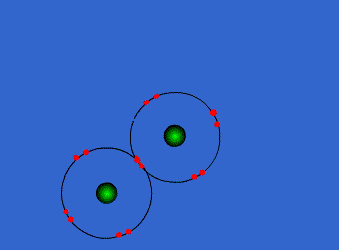
ويمكن أن يكون بين ذرتين رابطة تساهمية واحدة أو اثنتان أو ثلاث روابط .


وتتكون الرابطة التساهمية عادةً بين ذرات العناصر اللا فلزية ( متشابهه أو
غير متشابهة ) كما أن العناصر العليا في المجموعة الرابعة ( وأهمها
عنصرالكربون ) تميل دائماً إلى تكوين روابط تساهمية ، وقد ترتبط بعض
الفلزات ( كالبريليوم ) بروابط تساهمية مع عناصر أخرى .
خواص المركبات التساهمية
في المركبات التساهمية ( بعكس المركبات الأيونية ) يمكن لنا أن نتحدث عن
جزيئات مستقلة فالمركبات التساهمية تتألف من جزيئات مستقلة ترتبط ببعضها
بروابط مختلفة ( فان درفال ، هيدروجينية ) متفاوتة في قوتها . لذلك توجد
المركبات التساهمية في جميع الحالات الثلاث حسب قوة هذه الروابط فهناك
مركبات تساهمية في حالة غازية ( روابط ضعيفة بين الجزيئات ) ومركبات
تساهمية في حالة سائلة وأيضاً يوجد مركبات تساهمية في حالة صلبة ( روابط
قوية بين الجزيئات ) ونفس الشيء بالنسبة لدرجات الانصهار والغليان
فالمركبات التساهمية تتفاوت في درجات غليانها وانصهارها حسب نوعية وقوة
الروابط بين الجزيئات .
أما بالنسبة للتوصيل الكهربي ففي الحالة النقية تكون المركبات التساهمية
غير موصلة للكهرباء في الغالب نظراً لكونها غير مشحونة أصلاً أو لكونها
متعادلة كهربياً في حالة وجود شحنات ، ولكن قد يكون للمشحونة منها ما يعرف
باسم العزم الكهربي وسيأتي .
وكذلك في مصاهيرها فمصهور المركب التساهمي الصلب ( كمصهور السكر مثلاً )
غير موصل للكهرباء ، أما بالنسبة للمحلول فقد يكون غير موصل كما في حالة
محلول السكر أو يكون موصلاً كما هو الحال في محلول كلوريد الهيدروجين ( حمض
الهيدروكلوريك ) ويرجع سبب التوصيل من عدمه في المحلول إلى تأين المركب
التساهمي ( تحوله إلى أيونات منفصلة بفعل المذيب ) أو عدم تأينه .
فالسكر لا يتأين عند إذابته في الماء وإنما تنفصل جزيئاته عن بعضها فقط
بينما يتأين كلوريد الهيدروجين إلى أيون الهيدروجين وأيون الكلور .
تراكيب لويس
يمكن تمثيل جزيئات المركبات التساهمية وتوضيح كيفية تكون الروابط فيها عن
طريق ما يعرف باسم تركيب لويس ، وفيما يلي سنتعرف على تركيب لويس لبعض
الذرات وبعض الجزيئات التساهمية :
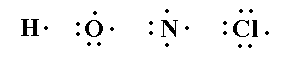

يلاحظ من خلال هذه التراكيب أن هناك أزواج الكترونية رابطة ( روابط تساهمية ) وأزواج الكترونية غير رابطة ( أزواج الكترونية حرة ) .
تطبيق : وضح تركيب لويس لكلٍ من الجزيئات التساهمية التالية :
جزيء الهيدروجين ، جزيء النيتروجين ، جزيء الماء : النشادر , الميثان ،
فلوريد الهيدروجين ، كلوريد الهيدروجين ، فلوريد البورون ، ، كلوريد
البريليوم ، خامس كلوريد الفسفور .
القاعدة الثمانية
يلاحظ في تراكيب لويس أن الذرات ( المركزية والطرفية ) في الجزيء التساهمي
تحاط بثمانية الكترونات ( بالنسبة للهيدروجين الكترونين ) لتصل بذلك إلى
التركيب الالكتروني الثابت والمستقر لتماثل التركيب الالكتروني لأقرب غاز
خامل ، تعرف هذه الظاهرة باسم القاعدة الثمانية ، وبالرغم من أن هذه
الظاهرة تنطبق على معظم الجزيئات التساهمية إلا أن هناك شذوذاً عن هذه
القاعدة إما بأكثر من ثمانية الكترونات كما هو الحال في خامس كلوريد
الفسفور ( يوجد عشرة الكترونات حول ذرة الفسفور المركزية ) أو أقل من
ثمانية كما هو الحال في فلوريد البورون ( ستة الكترونات حول ذرة البورون
المركزية ) .

جزيء ثالث فلوريد الفسفور يتبع القاعدة الثمانية

جزيء خامس فلوريد الفسفور يشذ عن القاعدة الثمانية
وهذا فلاش تفاعلي راااائع للغاية يمكن من خلاله تكوين تراكيب لويس للكثير من الجزيئات التساهمية
لحفظ الفلاش بجهازك أضغط بالزر الأيمن للماوس واختار حفظ باسم .
وهنا برنامج يتعلق أيضاً بتراكيب لويس بالامكان تحميله والعمل عليه دون اتصال . رائع فعلاًً ..
تفضل اضغط هنا للتحميل
بعد فك الضغط عن الملف ستجد ملف باسم DEMO1 انقر عليه نقر مزدوج ليعمل البرنامج مباشرة بالجهاز دون حاجة للتثبيت .
الأشكال الهندسية للجزيئات التساهمية
كما هو معروف فإن الجزيئات التساهمية عبارة عن جزيئات مستقلة تتألف من ذرة
مركزية وذرة أو أكثر طرفية ويوجد حول الذرة المركزية عدد من الأزواج
الالكترونية الرابطة أو ( الرابطة وغير الرابطة ) . ونظراً لأن هذه الأزواج
الالكترونية تتألف من الكترونات سالبة متشابهة في الشحنة فالمتوقع أن يكون
هناك تنافر بينها ، هذا التنافر بين الأزواج الالكترونية الموجودة حول
الذرة المركزية في الجزيء التساهمي يجبرالجزيء التساهمي على اتخاذ شكل
هندسي في الفراغ يحدده عدد هذه الأزواج الالكترونية . ويتحدد مقدار الزوايا
بين هذه الروابط على نوعية الشكل الهندسي الفراغي الذي يتخذه الجزيء وعلى
عدد الأزواج الالكترونية الحرة الموجودة بالجزيء.
ومن أهم هذه الأشكال الهندسية للجزيئات التساهمية ما يلي :
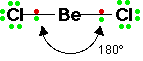
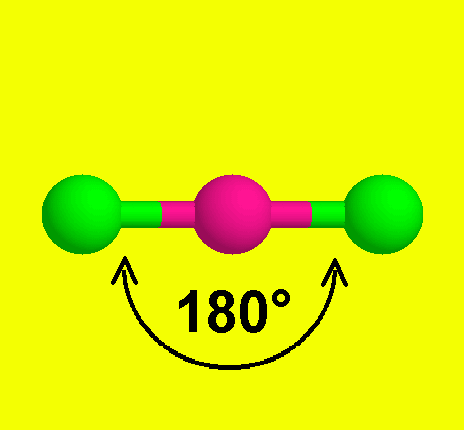
* الشكل الخطي ومثاله كلوريد البريليوم BeCl2
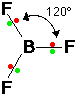
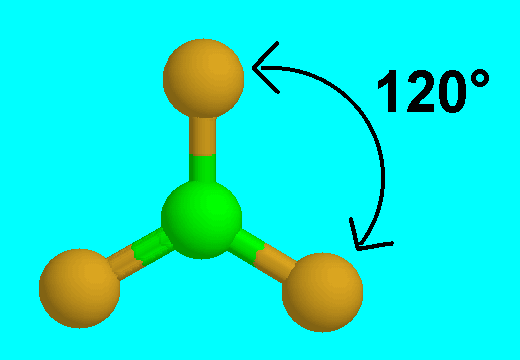
* المثلث متساوي الأضلاع ومثاله فلوريد البورون BF3
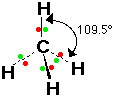
* الهرم الرباعي السطوح ومثاله مايلي :
1- الميثان CH4

ومثله أيون الأمونيوم +NH4
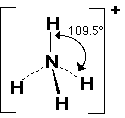
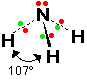
2- النشادر NH3

http://www.onefd.edu.dz/infpe/2MEF/cours-Pdf-2mef/Env2/Phys/env2_pL05.pdf


ويمكن أن يكون بين ذرتين رابطة تساهمية واحدة أو اثنتان أو ثلاث روابط .


وتتكون الرابطة التساهمية عادةً بين ذرات العناصر اللا فلزية ( متشابهه أو
غير متشابهة ) كما أن العناصر العليا في المجموعة الرابعة ( وأهمها
عنصرالكربون ) تميل دائماً إلى تكوين روابط تساهمية ، وقد ترتبط بعض
الفلزات ( كالبريليوم ) بروابط تساهمية مع عناصر أخرى .
خواص المركبات التساهمية
في المركبات التساهمية ( بعكس المركبات الأيونية ) يمكن لنا أن نتحدث عن
جزيئات مستقلة فالمركبات التساهمية تتألف من جزيئات مستقلة ترتبط ببعضها
بروابط مختلفة ( فان درفال ، هيدروجينية ) متفاوتة في قوتها . لذلك توجد
المركبات التساهمية في جميع الحالات الثلاث حسب قوة هذه الروابط فهناك
مركبات تساهمية في حالة غازية ( روابط ضعيفة بين الجزيئات ) ومركبات
تساهمية في حالة سائلة وأيضاً يوجد مركبات تساهمية في حالة صلبة ( روابط
قوية بين الجزيئات ) ونفس الشيء بالنسبة لدرجات الانصهار والغليان
فالمركبات التساهمية تتفاوت في درجات غليانها وانصهارها حسب نوعية وقوة
الروابط بين الجزيئات .
أما بالنسبة للتوصيل الكهربي ففي الحالة النقية تكون المركبات التساهمية
غير موصلة للكهرباء في الغالب نظراً لكونها غير مشحونة أصلاً أو لكونها
متعادلة كهربياً في حالة وجود شحنات ، ولكن قد يكون للمشحونة منها ما يعرف
باسم العزم الكهربي وسيأتي .
وكذلك في مصاهيرها فمصهور المركب التساهمي الصلب ( كمصهور السكر مثلاً )
غير موصل للكهرباء ، أما بالنسبة للمحلول فقد يكون غير موصل كما في حالة
محلول السكر أو يكون موصلاً كما هو الحال في محلول كلوريد الهيدروجين ( حمض
الهيدروكلوريك ) ويرجع سبب التوصيل من عدمه في المحلول إلى تأين المركب
التساهمي ( تحوله إلى أيونات منفصلة بفعل المذيب ) أو عدم تأينه .
فالسكر لا يتأين عند إذابته في الماء وإنما تنفصل جزيئاته عن بعضها فقط
بينما يتأين كلوريد الهيدروجين إلى أيون الهيدروجين وأيون الكلور .
تراكيب لويس
يمكن تمثيل جزيئات المركبات التساهمية وتوضيح كيفية تكون الروابط فيها عن
طريق ما يعرف باسم تركيب لويس ، وفيما يلي سنتعرف على تركيب لويس لبعض
الذرات وبعض الجزيئات التساهمية :
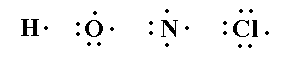

يلاحظ من خلال هذه التراكيب أن هناك أزواج الكترونية رابطة ( روابط تساهمية ) وأزواج الكترونية غير رابطة ( أزواج الكترونية حرة ) .
تطبيق : وضح تركيب لويس لكلٍ من الجزيئات التساهمية التالية :
جزيء الهيدروجين ، جزيء النيتروجين ، جزيء الماء : النشادر , الميثان ،
فلوريد الهيدروجين ، كلوريد الهيدروجين ، فلوريد البورون ، ، كلوريد
البريليوم ، خامس كلوريد الفسفور .
القاعدة الثمانية
يلاحظ في تراكيب لويس أن الذرات ( المركزية والطرفية ) في الجزيء التساهمي
تحاط بثمانية الكترونات ( بالنسبة للهيدروجين الكترونين ) لتصل بذلك إلى
التركيب الالكتروني الثابت والمستقر لتماثل التركيب الالكتروني لأقرب غاز
خامل ، تعرف هذه الظاهرة باسم القاعدة الثمانية ، وبالرغم من أن هذه
الظاهرة تنطبق على معظم الجزيئات التساهمية إلا أن هناك شذوذاً عن هذه
القاعدة إما بأكثر من ثمانية الكترونات كما هو الحال في خامس كلوريد
الفسفور ( يوجد عشرة الكترونات حول ذرة الفسفور المركزية ) أو أقل من
ثمانية كما هو الحال في فلوريد البورون ( ستة الكترونات حول ذرة البورون
المركزية ) .

جزيء ثالث فلوريد الفسفور يتبع القاعدة الثمانية

جزيء خامس فلوريد الفسفور يشذ عن القاعدة الثمانية
وهذا فلاش تفاعلي راااائع للغاية يمكن من خلاله تكوين تراكيب لويس للكثير من الجزيئات التساهمية
لحفظ الفلاش بجهازك أضغط بالزر الأيمن للماوس واختار حفظ باسم .
وهنا برنامج يتعلق أيضاً بتراكيب لويس بالامكان تحميله والعمل عليه دون اتصال . رائع فعلاًً ..
تفضل اضغط هنا للتحميل
بعد فك الضغط عن الملف ستجد ملف باسم DEMO1 انقر عليه نقر مزدوج ليعمل البرنامج مباشرة بالجهاز دون حاجة للتثبيت .
الأشكال الهندسية للجزيئات التساهمية
كما هو معروف فإن الجزيئات التساهمية عبارة عن جزيئات مستقلة تتألف من ذرة
مركزية وذرة أو أكثر طرفية ويوجد حول الذرة المركزية عدد من الأزواج
الالكترونية الرابطة أو ( الرابطة وغير الرابطة ) . ونظراً لأن هذه الأزواج
الالكترونية تتألف من الكترونات سالبة متشابهة في الشحنة فالمتوقع أن يكون
هناك تنافر بينها ، هذا التنافر بين الأزواج الالكترونية الموجودة حول
الذرة المركزية في الجزيء التساهمي يجبرالجزيء التساهمي على اتخاذ شكل
هندسي في الفراغ يحدده عدد هذه الأزواج الالكترونية . ويتحدد مقدار الزوايا
بين هذه الروابط على نوعية الشكل الهندسي الفراغي الذي يتخذه الجزيء وعلى
عدد الأزواج الالكترونية الحرة الموجودة بالجزيء.
ومن أهم هذه الأشكال الهندسية للجزيئات التساهمية ما يلي :
* الشكل الخطي ومثاله كلوريد البريليوم BeCl2


* المثلث متساوي الأضلاع ومثاله فلوريد البورون BF3


* الهرم الرباعي السطوح ومثاله مايلي :
1- الميثان CH4


ومثله أيون الأمونيوم +NH4

2- النشادر NH3


http://www.onefd.edu.dz/infpe/2MEF/cours-Pdf-2mef/Env2/Phys/env2_pL05.pdf
عدل سابقا من قبل براء في الجمعة 25 يناير - 12:24 عدل 1 مرات

